电穿孔(Electroporation,EP)技术出现于20世纪80年代中期。电穿孔是一个物理过程,细胞在高电压场强的作用下,细胞膜发生暂时的重新排列,结果使细胞膜具有临时性的大分子可通透性,可从周围环境中摄入包括核酸、蛋白质、碳水化合物一类的大分子以及其他一些小分子。
与传统的瞬转方法:原生质体融合法,磷酸钙与DNA或重组噬菌体共沉淀法,DEAE-葡聚糖法,脂质体法方法相比,电穿孔技术具有简单易行、重复性好、效率较高、电参数容易控制和调整、作用机理相对比较清楚等优点。近年来,脉冲电场对细胞膜的电穿孔效应获得了广泛深入的研究,在生物、医学治疗方面有了重大应用。
欢迎了解我们的电转仪。
如何应用上电转仪呢?
一、试剂耗材准备
细胞培养基DMEM或1640、FBS、0.25%胰蛋白酶 (自配,无菌)、PBS (自配,无菌)、电转缓冲液(自主研发)。
细胞、用具准备电转仪器、电转杯(1mm)、电转液、毛细管枪头、6孔板、倒置荧光显微镜、移液器。
二、细胞实验流程
1、细胞准备:细胞消化,用PBS处理成细胞悬液计数,离心(1000rpm,5min)弃PBS;用电转液重悬细胞,最终加入的细胞悬液为每个电转杯85ul,细胞量在1×105-1×106个;
2、细胞悬液中加入质粒8.5ug(终浓度10ug/mL),混匀;
3、毛细管枪头移取85uL到电转杯,从底部加入,保证没有气泡,气泡会影响电转效果;
4、调好仪器参数,逐个电转,电转结束后迅速加入少量培养基;
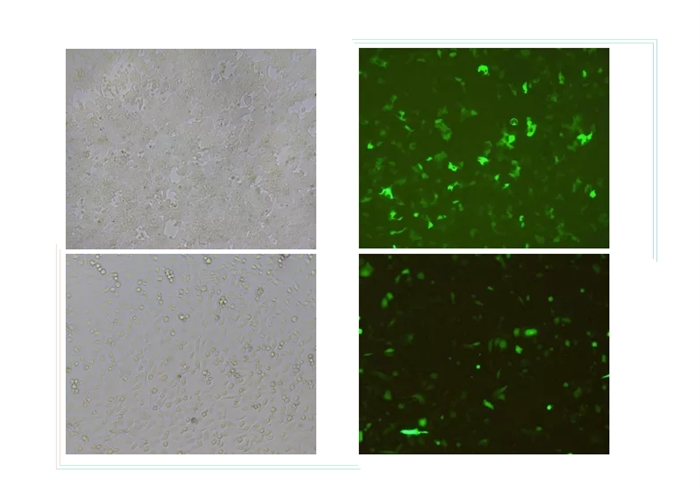
5、六孔板中提前加入2mL完全培养基,电转细胞悬液吸出加入到孔板,37℃培养箱静置培养24-48h,观察荧光蛋白表达,计算电转效率;电转后第2天观察细胞存活率。
三、电转流程图
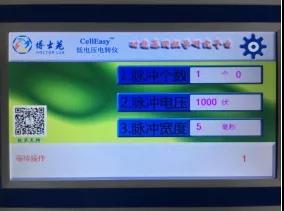
1、仪器连接电源,打开电源键,设置脉冲个数、脉冲电压、脉冲宽度;

2、移液管转移HYYTM电转液重悬的细胞到电转杯;
 3、拉出卡槽,轻轻放入电转杯,卡槽放回原位;
3、拉出卡槽,轻轻放入电转杯,卡槽放回原位;
 4、点击start,充电-放点;
4、点击start,充电-放点;
 5、转移样本到培养板。
5、转移样本到培养板。
如此,我们的细胞电转实验就完成了,超级方便快捷的。
一定有小伙伴担心转染效率不行,话不多说,直接上图吧!